Número:
- Vol. 3
- Num. 14
- Marzo - Abril
Ganaderia.com
Autores:
 Diana Sofía
Diana Sofía Andrade Chacón
Nacionalidad: Mexicana
Grado académico: Médica Veterinaria Zootecnista
 Eligio Gabriel
Eligio Gabriel Salgado Hernández
ISSN-e:
2992-7293
La importancia de la vitamina (hormona) D en vacas lecheras
RESUMEN
En los bovinos, la vitamina D se obtiene a través de la exposición solar, el consumo de alimento o cuando se administra de manera parenteral. Posteriormente, se convierte en diversos metabolitos hasta su forma más bioactiva, el calcitriol el cual actúa sobre receptores localizados en diversos órganos, debido a esto se considera una hormona más que una vitamina. De las funciones más estudiadas del calcitriol están la regulación de concentraciones sanguíneas de calcio a través de la absorción intestinal de calcio y la estimulación de la resorción ósea. Estudios recientes sugieren otras funciones importantes por la presencia de su receptor en diferentes células, entre ellas del sistema inmune. Las dosis sugeridas para su suplementación en el alimento se encuentran bajo investigación. Actualmente, el NRC propone dosis de suplementación de los diferentes metabolitos de la vitamina D, basados en su acción mineralizante a nivel óseo. Sin embargo, estudios recientes sugieren que las dosis con efectos reguladores del sistema inmune bovino podrían ser mayores. Adicionalmente, existen diversos factores como raza, color de pelo, sistema de producción, latitud, etc., que podrían influir en la síntesis y en los requerimientos de vitamina D y por lo tanto en la cantidad a suplementar en la dieta, por lo que su estudio es un área de oportunidad para la investigación.
INTRODUCCIÓN
La hipocalcemia es una enfermedad metabólica de gran importancia en la producción de leche bovina. Durante el periodo periparto, las demandas fisiológicas de calcio aumentan por el inicio de la producción de leche, ya que se secreta alrededor de 30-40g de calcio al día (Seifi & Kia, 2017). Cuando estas demandas de calcio exceden los mecanismos compensatorios, las vacas presentan un cuadro de hipocalcemia. Se ha encontrado que aproximadamente uno de un 5-10% de las vacas frescas presentan hipocalcemia clínica y un 30-50% presentan hipocalcemia subclínica (Vargas, 2015; Seifi & Kia, 2017).
En el bovino, las concentraciones normales de calcio en sangre se encuentran entre 2.1-2.5 mmol/L (Seifi & Kia, 2017). Cuando la concentración de calcio está por debajo del límite inferior, la vaca puede presentar hipocalcemia subclínica o clínica. Para recuperar la concentración sérica de Ca se activan diversos mecanismos fisiológicos, dentro de los cuales destaca la participación de los metabolitos de la vitamina D, por lo que su demanda aumenta. Se ha observado también que las vacas que presentan hipocalcemia tienen mayor riesgo de presentar diversas infecciones en los días subsecuentes, esto es debido a que el calcio juega un papel muy importante en la regulación del sistema inmune (Martínez et al 2018).
Sin embargo, el calcitriol también tiene funciones similares al calcio. A este compuesto se le conoce también como vitamina D activa, sin embargo, debido a que este compuesto actúa sobre receptores en diversas células y tejidos de manera similar a las hormonas actualmente se considera más una hormona que una vitamina, por lo que en este escrito será utilizado con mayor frecuencia el nombre de calcitriol. Se ha descrito con mucha claridad el papel que juega el calcitriol en la regulación de la calcemia, sin embargo, se han encontrado muchas funciones diferentes en el organismo, por lo que la finalidad de este artículo es destacar el papel de los metabolitos de la vitamina D en la regulación de la normocalcemia, así como otras funciones de regulación en el sistema inmune y en la prevención de enfermedades durante el periodo de transición en la vaca lechera.
METABOLISMO DE LA VITAMINA D
Los bovinos al igual que muchos animales obtienen la vitamina D a través de tres vías, del alimento, de la exposición solar o cuando se administra de forma parenteral (NRC, 2001; Dusso et al., 2005). Dependiendo de su origen la vitamina D se encuentra en forma de ergocalciferol (vitamina D2) proveniente de los hongos que crecen en los vegetales, o en forma de colecalciferol (vitamina D3) cuando proviene de la síntesis en la piel de fuentes animales. Ambas formas se metabolizan de manera similar (Eder & Grundmann, 2022) y son capaces de llevar a cabo funciones biológicas, sin embargo, el colecalciferol es el más bioactivo por su mayor afinidad a receptores que le confiere características diferentes en su vida media y actividad biológica.
La vitamina D también es considerada una prohormona (Dusso et al., 2005; Eder & Grundmann, 2022) porque sus metabolitos el calcidiol y el calcitriol actúan sobre receptores de manera similar a las hormonas. La vitamina D3 se produce en la piel, al nivel de la epidermis, en esta se encuentra una molécula llamada 7-dehidrocolesterol, el cual por incidencia de los rayos UV tipo B se transforma en previtamina D. Posteriormente por acción de la temperatura corporal se suma otro cambio de forma dando paso al colecalciferol o vitamina D3. Si el colecalciferol o ergocalciferol son consumidos a través del alimento, por su naturaleza lipofílica, se absorbe en estructuras llamadas quilomicrones a nivel de intestino pasando al sistema linfático y posteriormente al espacio intravascular (Eder & Grundmann, 2022). Una vez en sangre el 99% de los metabolitos se unen a una proteína transportadora de vitamina D (VDBP, por sus siglas en inglés) (Kochupillai et al., 2008) el resto se puede unir a albúmina o quedar libre. Cuando la vitamina D se une a la VDBP viaja al hígado donde, a través de la acción de la enzima 25-hidroxilasa, se une un grupo hidroxilo en el carbono 25 teniendo como resultado a la 25 hidroxivitamina D o calcidiol. Posteriormente, el calcidiol es liberado a la sangre y se une a la VDBP para que llegue a diversas células y tejidos. En estos, el calcidiol se une con el receptor de vitamina D (VDR) y se internaliza en las células en donde la enzima 1α-hidroxilasa agrega otro grupo hidroxilo en el carbono 1 llegando así al metabolito más bioactivo, la 1-25 dihidroxivitamina D o calcitriol. Este proceso biológico ha sido extensamente estudiado en las células epiteliales de los túbulos contorneados proximales del riñón, sin embargo, en los últimos años se ha descubierto que la enzima 1α hidroxilasa se activa también en diversos tejidos como la misma piel, el cerebro, la placenta, músculo, glándula mamaria y células del sistema inmune, entre otros lo cual nos hace suponer que el calcitriol tiene efectos en múltiples órganos y participa en la regulación de diversas funciones biológicas.
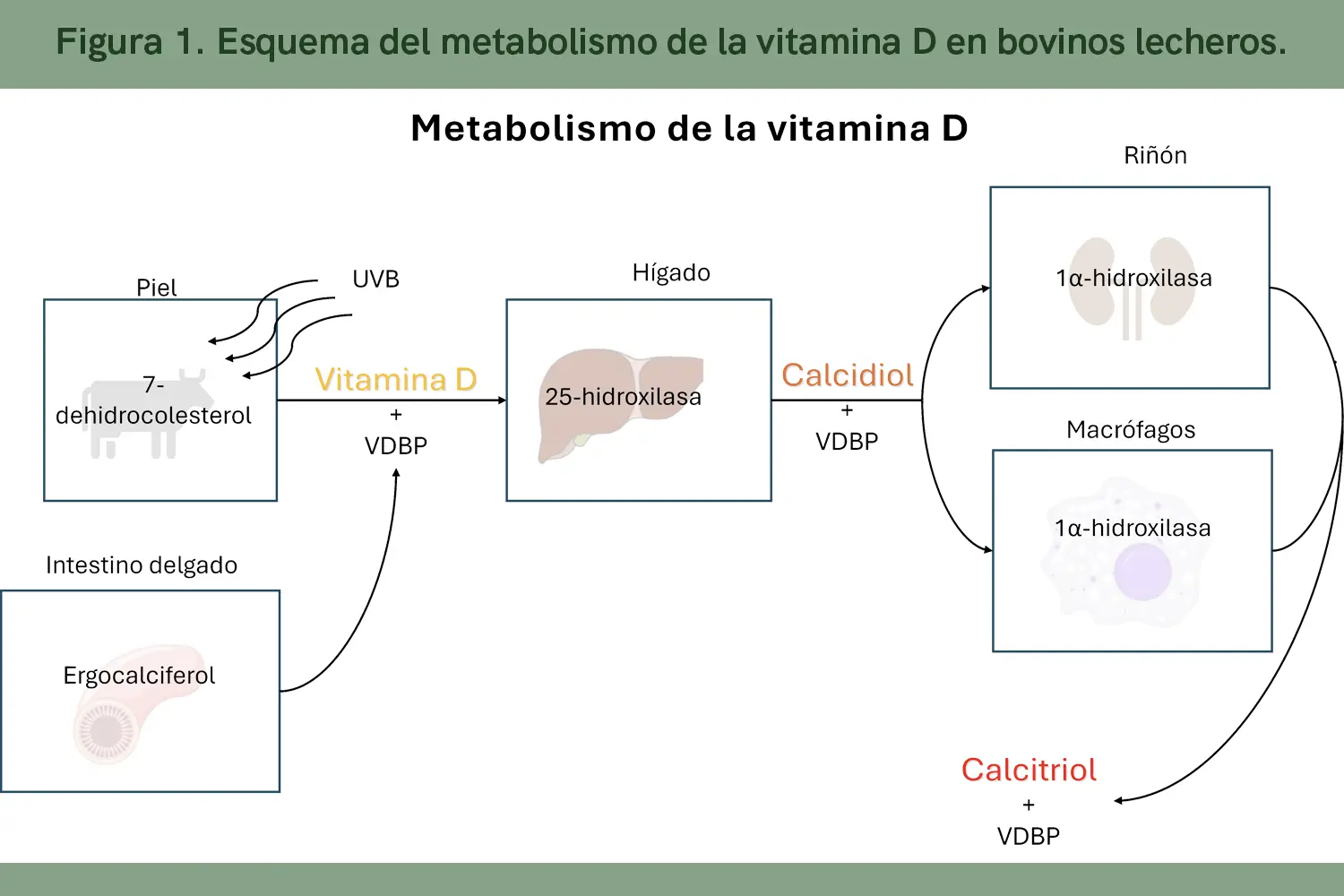
La VDBP tiene un papel más importante que solo transportar los metabolitos, también es una forma de almacenamiento (Hymoller & Jensen, 2017; Eder & Grundmann, 2022). Cuando los metabolitos están unidos a la VDBP dificulta la entrada a las células blanco (Dusso et al., 2005), disminuyendo así su biodisponibilidad y degradación, aumentado su vida media en sangre. Sin embargo, este efecto depende de la afinidad que tiene cada metabolito, por ejemplo, la afinidad de esta proteína hacia el calcidiol es mayor, seguido por el calcitriol y finalmente hacia la vitamina D (Dusso et al., 2005; Kochupillai, 2008).
En la ruta metabólica de la vitamina D, el calcitriol es el último producto con función biológica, sin embargo, se producen otros metabolitos inactivos con el propósito de evitar intoxicaciones. Cuando el calcitriol se encuentra en altas concentraciones se activan algunos mecanismos biológicos para su propia degradación. Uno de estos mecanismos es reducir la expresión de genes que codifican para la enzima 1α hidroxilasa, por otro lado, aumenta la expresión del factor de crecimiento de fibroblastos (FGF23) (Hodnik et a., 2020) el cual inhibe la secreción de parathormona (PTH). Con estas acciones en conjunto se reduce la expresión de 1α hidroxilasa y la síntesis de calcitriol.
Además, este exceso de calcitriol promueve la activación de la enzima 24 hidroxilasa, la cual puede actuar en calcitriol y calcidiol agregando un grupo hidroxilo en el carbono 24 (Hodnik et al., 2020) y después de varias reacciones se forma 24-25 dihidroxitamina D o ácido calcitroico, el cual no tiene acción biológica y puede ser eliminado fácilmente en la orina, ya que es una molécula hidrosoluble. Sin embargo, estos mecanismos han sido más estudiados en humanos y ratones, por lo que es de gran interés investigar cuáles y en qué magnitud se activan estas rutas de degradación de los metabolitos de la vitamina D en bovinos.
Existen otros factores que pueden afectar la síntesis de calcitriol, por ejemplo, el exceso de fósforo y calcio en la dieta inhibe la actividad de la 1α hidroxilasa (Slatopolsky, 1998). Por otro lado, el aumento en el pH reduce la afinidad de la PTH hacia sus receptores (Disthabanchong et al., 2002). Además, se ha demostrado que la deficiencia de magnesio inhibe la secreción de PTH (Brown & Chen, 1989; Vetter & Lohse, 2002), en consecuencia, la actividad de la enzima 1α hidroxilasa se reduce y por ende se produce una menor síntesis de calcitriol lo cual aumenta el riesgo de hipocalcemia posparto y otras enfermedades relacionadas.
FUNCIONES DEL CALCITRIOL
De manera general, las funciones del calcitriol se clasifican en genómicas y no genómicas. Esta clasificación está dada por su efecto sobre la transcripción de genes o mediadas por receptores de superficie de membrana, lo cual está asociado con la velocidad de respuesta. Los ejemplos más estudiados de las funciones no genómicas son el movimiento de calcio a nivel de intestino delgado de la membrana luminal a la basolateral; y en condrocitos donde modifica la producción de prostaglandina y su actividad proteasa teniendo como resultado la modificación de la matriz ósea y la calcificación. En las funciones genómicas el calcitriol estimula la transcripción de genes que codifican para diversas enzimas y proteínas las cuales regulan las múltiples funciones del calcitriol (Dusso, 2005).
La función más estudiada y de mayor importancia del calcitriol es la regulación de las concentraciones sanguíneas de calcio y fósforo. A nivel intestinal el calcitriol estimula la expresión de canales de calcio como TRPV5 y TRPV6 los cuales están implicados en la absorción de este mineral. Dentro del enterocito el calcitriol aumenta la expresión de genes para la síntesis de calbindina Dk9, la cual es una proteína que se une al calcio y facilita su paso a través del enterocito. Adicionalmente, el calcitriol incrementa la expresión de la bomba calcio ATPasa (PMCA1b), lo cual permite el paso de calcio hacia el torrente sanguíneo (Hernández-Castellano et al., 2019). El calcitriol también estimula la expresión del cotransportador Na-P lo cual contribuye a la absorción de fósforo a nivel intestinal (Dusso et al., 2005). En el hueso, junto con la PTH, el calcitriol estimula la resorción ósea a través del ligando del receptor nuclear Kappa beta (RANKL) en los osteoclastos (Suda et al., 2012). Desde hace muchos años se ha demostrado que la deficiencia de vitamina D ocasiona raquitismo en niños y animales en crecimiento, el consumo de vitamina D resuelve este problema, pero a la fecha no se tiene claro el mecanismo mediante el cual la vitamina D participa en la formación de hueso nuevo.
Sin embargo, estudios recientes sugieren otras funciones importantes. Se ha descubierto que células diferentes a las renales también expresan el VDR y genes que codifican para la enzima 1α-hidroxilasa, siendo capaces de internalizar calcidiol y convertirlo a calcitriol (Eder & Grundmann, 2022). Las células en las que se ha confirmado la presencia de estas características son células dendríticas, de la paratiroides, epiteliales de la glándula mamaria, células del endotelio vascular, enterocitos, células del estroma decidual, células del trofoblasto, células epiteliales de la próstata, queratinocitos y macrófagos, sin embargo, la función que desencadena en cada una aún no está clara (Eder & Grundmann, 2022). Lo anterior ha dado paso a la hipótesis que el calcitriol puede ser clave para desencadenar funciones importantes como inducción de la diferenciación celular, inmunomodulación y control de algunos sistemas hormonales (Dusso, 2005; Nelson et al., 2012; Viera-Neto et al., 2017).
En células del sistema inmune innato, tales como los monocitos, incrementa la expresión de la óxido nítrico sintetasa, RANTES (quimiocina de regulación por activación expresada y secretada por los linfocitos T) y una proteína de unión a calcio. (Nelson et al., 2010).
En el sistema inmune adaptativo inhibe la proliferación de linfocitos T, producción de INFɤ, IL-17A e IL1-7F, en bovinos (Nelson et al., 2012).
DEFICIENCIAS DE VITAMINA D Y SUS METABOLITOS
Para saber el estatus de vitamina D en animales, el metabolito por excelencia que se utiliza para su medición es el calcidiol. De acuerdo con el NRC, la concentración sanguínea ideal para el metabolismo del calcio en bovinos lecheros es de 20-30 ng/ml, cuando la concentración es menor a 5 ng/ml se considera deficiencia severa de vitamina D (NRC, 2001; Eder & Grundmann, 2022), en este caso el animal puede presentar condiciones como raquitismo, osteomalacia, fracturas y laminitis (Dusso et al., 2005).
Por otro lado, la concentración de calcidiol para una respuesta inmune óptima ha sido motivo de debate e investigación en los últimos años tanto en humanos como en animales. Wisnieski et al., (2020) observaron que vacas lecheras con concentraciones por debajo de 71.4 ng/ml entre los 2 a 10 días posparto son más susceptibles a presentar enfermedades uterinas, con base en esto proponen al calcidiol como un posible marcador de enfermedades posparto en vacas lecheras. Otros estudios sugieren una relación entre las concentraciones bajas de calcidiol y la presentación de enfermedades específicas como paratuberculosis (Sorge et al., 2013) o retención placentaria, metritis (Martínez et al., 2018) e infecciones respiratorias (Nonnecke et al., 2014). Además, se ha visto un efecto favorable de la aplicación local de calcidiol para la resolución de casos de mastitis bacterianas (Nelson et al., 2011). Durante el periodo de transición la concentración de calcidiol disminuye ligeramente (Holcombe et al., 2018), lo cual nos hace suponer el papel del calcidiol en la regulación de la respuesta inmune disminuida durante este periodo.
INTOXICACIÓN CON METABOLITOS DE VITAMINA D
Para que el calcidiol alcance dosis tóxicas se debería estar en valores por arriba de 300 ng/ml (NRC, 2001; Hodnik et al., 2020). Esto podría ser consecuencia de una sobreestimulación del VDR que puede dar origen a calcinosis en tejidos blandos que se evidencía con los signos clínicos como emaciación, recumbencia, problemas de locomoción, aumento de la frecuencia respiratoria y cardiaca y disminución de la fertilidad (Hodnik et al., 2020; Wisnieski et al., 2020). Cabe resaltar que estos signos son vistos a largo plazo y no de manera inmediata al suplementar de manera excesiva con metabolitos de la vitamina D.
Algunas plantas como Trisetum flavescens y Solanum malacoxylon pueden contener altas concentraciones de metabolitos de la vitamina D y su consumo en exceso puede provocar intoxicación.
SUPLEMENTACIÓN
La mayoría de los ingredientes utilizados para la alimentación de bovinos son deficientes para cubrir los requerimientos diarios de vitamina D (Shimada et al., 2017) propuestos por el NRC (21,000 UI/día), por lo que la suplementación en la dieta de ganado lechero es necesaria. Los metabolitos más usados son vitamina D y calcidiol, sin embargo, la dosis diaria para mejorar la función inmune sigue en investigación. El calcitriol se ha suplementado de manera experimental en bovinos a dosis de 200-300µg /día/animal (Viera-Neto et al., 2017) y en algunas condiciones médicas en humanos, pero no se recomienda su uso rutinario por su alto riesgo de alcanzar dosis toxicas.
En el caso de suplementación con colecalciferol, el NRC recomienda una dosis de 20 UI/kg PV/día considerando solo su efecto en la mineralización ósea. Sin embargo, algunos estudios han encontrado que la administración de 30 UI/kg de PV logra concentraciones de 42 ng/ml en sangre y 58 UI/ kg de PV alcanzan hasta 70 ng/ml (Wisnieski et al., 2020; Eder & Grundmann, 2022) acercándose más a la dosis recomendada por Nelson et al., 2016 (68±22 ng/ml) para mejorar la función inmune innata en ciertas etapas de la producción.
En el caso del calcidiol, se ha visto que dosis de 3mg/vaca/día han mejorado los parámetros productivos y de salud en vacas lecheras (Wilkens et al., 2012; Martínez et al., 2018), sin embargo, esto debe tomarse con reserva, ya que la suplementación con cualquier metabolito de vitamina D dependerá de la capacidad de síntesis cutánea de vitamina D por lo que diversos factores tales como la latitud y altitud a la que se encuentran los animales, su color de pelo y piel, la disponibilidad de radiación solar debido a instalaciones y manejo pueden influir en las concentraciones plasmáticas requiriendo mayor o menor cantidad de vitamina D en el alimento. Es por ello que se requiere hacer más investigación al respecto en latitudes más cercanas al Ecuador para poder establecer las dosis adecuadas considerando las condiciones particulares de cada unidad de producción.
Bibliografía
Dusso, A. S., Brown, A. J., & Slatopolsky, E. (2005). Vitamin D. American Journal of Physiology-Renal Physiology, 289, F8-F28.
Eder, K. & Grundmann, S. M. (2022). Vitamin D in dairy cows: metabolism, status and functions in the immune system. Archives of Animal Nutrition, 76, 1-33.
Hernández-Castellano, L. E., Hernandez, L. L. & Bruckmaier, R. M. (2019). Review: Endocrine pathways to regulate calcium homeostasis around parturition and the prevention of hypocalcemia in periparturient dairy cows. Animal, 14(2), 330-338.
Hodnik, J. J., Jezek, J., & Staric, J. (2020). A review of vitamin D and its importance to the health of dairy cattle. Journal of Dairy Research, 87, 84-87.
Holcombe, A. J., Wisnieski, L., Gandy, J., Norby, B., & Sordillo, M. (2018). Reduced serum vitamin D concentrations in healthy early lactation dairy cattle. Journal of Dairy Science, 101(2), 1488-1494.
Hymoller, L., & Jensen, S. K. (2017). Plasma transport of ergocalciferol and cholecalciferol and their 25-hydroxylated metabolites in dairy cows. Domestic Animal Endocrinology, 59, 44-52.
Kochupillai, N. (2008). The physiology of vitamin D: current concepts. Indian Journal of Medical Research, 127(3), 256-262.
Martínez, N., Rodney, R. M., Block, E., Hernandez, L. L., Nelson, C. D., Lean, I. J., & Santos, J. E. P. (2018). Effects of prepartum dietary cation-anion difference and source of vitamin D in dairy cows: lactation performance and energy metabolism. Journal of Dairy Science, 101(3), 2544-2562.
National Research Council. (2001). Nutrient requirements of dairy cattle. (7a). Washington: National Academy Press.
Nelson, C. D., Reinhardt, T. A., Beitz, D. C., & Lippolis, J. D. (2010). In vivo activation of the intracrine vitamin D pathway in innate immune cells and mammary tissue during a bacterial infection. PLoS One, 5(11), e15469.
Nelson, C. D., Reinhardt, T. A., Lippolis, J. D., Sacco, R. E., & Nonnecke, B. J. (2012). Vitamin D signaling in the bovine immune system: a model for understanding human vitamin D requirements. Nutrients, 4(3), 181-196.
Nelson, C. D., Lippolis, J. D., Reinhardt, T. A., Sacco, R. E., Powell, J. L., Drewnoski, M. E., O’Neil, M., Beitz, D. C., & Weiss, W. P. (2016). Vitamin D status of dairy cattle: outcomes of current practices in the dairy industry. Journal of Dairy Science, 99(12), 10150-10160.
Nonnecke, B. J., McGill, J. L., Ridpath, J. F., Sacco, R. E., Lippolis, J. D., & Reinhardt, T. A. (2014). Acute phase response elicited by experimental bovine diarrhea virus (BVDV) infection is associated with decreased vitamin D and E status of vitamin-replete preruminant calves. Journal of Dairy Science, 97(9), 5566-5579.
Seifi, H. A. & Kia, S. (2017). Subclinical hipocalcemia in dairy cows: pathophysiology, consequences and monitoring. Iranian Journal of Veterinary Science and Technology, 9(2), 1-15.
Slatopolsky, E. (1998). The role of calcium, phophorus and vitamin D metabolism in the development of secondary hyperparathyroidism. Nephrology Dialysis Transplantation, 13(3), 3-8.
Sorge, U. S., Molitor, T., Linn, J., Gallaher, D., & Wells, S. W. (2013). Cow-level association between serum 25-hydroxyvitamin D concentration and Mycobacterium avium subspecies paratuberculosis antibpdy serpositivity: a pilot study. Journal of Dairy Science, 96(2), 1030-1037
Vargas, Y. E. (2015). Prevalencia de hipocalcemia subclínica y factores predisponentes en vacas lecheras pre y post-parto bajo un sistema intensivo de producción. Tesis de licenciatura: Universidad Católica Santa María.
Vetter, T. & Lohse, M. J. (2002). Magnesium and the parathyroid. Current Opinion in Nephrology and Hypertension, 11(4), 403-410
Vieira-Neto, A., Lima, I. R. P., Lopes Jr, F., Lopera, C., Zimpel, R., Sinedino, L. D. P., Jeong, K. C., Galvao, K., Thatcher, W. W., Nelson, C. D., & Santos, J. E. P. (2017). Use of calcitriol to maintain postpartum blood calcium and improve immune function in dairy cows. Journal of Dairy Science, 100(7), 5805-5823
Wilkens, M. R., Oberheide, I., Schroder, B., Azem, E., Steinberg, W., & Breves, G. (2012). Influence of the combination of 25-hydroxyvitamin D3 and a diet negative cation-anion difference on peripartal calcium homeostasis of dairy cows. Journal of Dairy Science, 95, 151-164.
Wisnieski, L., Brown, J. L., Holcombe, S. J., Gandy, J. C., & Sordillo, L. M. (2020). Serum vitamin D concentrations at dry-off and close-up predict increased postpartum urine ketone concentrations in dairy cattle. Journal of Dairy Science, 103(2), 1795-1806.