Número:
- Vol. 2
- Num. 8
- Marzo - Abril
Ganaderia.com
Autores:
 César
César Rodríguez Beas
Nacionalidad: Mexicana
Grado académico: Doctor en Ciencias Biofísicas
 MN. Gloria Irma
MN. Gloria Irma Tapia Ayala
ISSN-e:
2992-7293
Liposomas fabricados con Lecitina de yema de huevo para la mejora de la técnica de criopreservación de esperma bovino
INTRODUCCIÓN
Por definición, la inseminación artificial (IA) es todo aquel método de reproducción asistida que consiste en el depósito de espermatozoides en la mujer o hembra mediante instrumental especializado y utilizando técnicas que reemplazan a la copulación, implantándolos en el tracto genital femenino: vagina, útero, cérvix, trompas de falopio, etc. con el fin de lograr la gestación.
 En el caso de los animales (Figura 1), es una técnica muy empleada para lograr el mejoramiento genético de los rebaños, ya que persigue principalmente el nacimiento de animales de alta productividad en un corto período de tiempo. Así mismo, el desarrollo de sistemas de pruebas de descendencia ha incrementado mucho gracias a la implementación de la IA en muchos tipos de animales.
En el caso de los animales (Figura 1), es una técnica muy empleada para lograr el mejoramiento genético de los rebaños, ya que persigue principalmente el nacimiento de animales de alta productividad en un corto período de tiempo. Así mismo, el desarrollo de sistemas de pruebas de descendencia ha incrementado mucho gracias a la implementación de la IA en muchos tipos de animales.
En el siglo XX, la IA en equinos, porcinos y otros animales fue iniciada en 1907 por Llya Ivanovich Ivanov [1], seguido más tarde por muchos otros investigadores, entre los que destaca Chris Polge [2], quien en 1956 destacó beneficios de la IA como:
? Mejoramiento del ganado ? comodidad para los operarios ? control de enfermedades ? grandes mejorías económicas ? facilitación de programa de cruzamiento ? etc.
En 1931, la IA en bovinos fue tan exitosa que los investigadores se dieron cuenta de que el semen recogido podría conservarse mezclándolo con huevo, debido a que éste contiene antibióticos y productos químicos, y congelarlo para su uso posterior. La IA en el ganado bovino ha sido muy importante en la industria de productos lácteos y la carne, debido a la mejora de la productividad y al aumento de la oferta de alimentos. La UF/IFAS menciona que, en la década de 1970, que los agricultores criaban más de 7 millones de vacas lecheras. El beneficio de la IA en bovinos es grande, de tal manera que se pueden destacar algunas ventajas como:
- El uso de sementales sobresalientes ofrece la oportunidad de mejorar genéticamente los animales del hato.
- El potencial reproductivo de un semental se incrementa, es decir, si un toro por monta natural puede cubrir entre 49 y 70 vacas por año, a través de la IA y con el uso de semen congelado se pueden servir cientos o miles de vacas por año.
- Se reducen los riesgos de transmitir enfermedades:
i) Llevando un control estricto de las enfermedades, de tal manera que no se procese el semen de animales enfermos.
ii) Se usan antibióticos para que se incorporen durante el proceso del semen.
4. A través de la IA se puede cubrir un gran número de vacas (15-20 o más) en un mismo día, condición que sería imposible en condiciones naturales, es decir, para un solo toro. Etc.
Sin embargo, a pesar de las muchas ventajas que presenta la IA, también se presentan desventajas como:
- Utilizar un toro no probado ni estudiado, en cuanto a sus características genéticas, puede traer como consecuencia la pérdida o una disminución en la producción de cualquier explotación.
- Es necesario contar con personal capacitado para el manejo del semen, la inseminación y además para una adecuada detección de los animales en celo.
- Las enfermedades pueden propagarse con gran rapidez en toros que no se les lleva un control sanitario estricto. La adición de antibióticos en el diluente, no es suficiente para controlar todas las enfermedades que pueden ser trasmitidas por el semen.
- Si no se tiene un buen manejo del semen en el proceso de la congelación/descongelación (criopreservación) se puede reducir (e incluso llegar a cero) el porcentaje de concepción del hato. Etc.
ANTECEDENTES
La industria de la cría de ganado a nivel mundial está basada en la IA y en la criopreservación del semen. El extensivo uso de la IA ha permitido una selección genética acelerada y un mejoramiento en la producción de crías en distintos tipos de ganado. Continuamente, las investigaciones están mejorando los métodos por los cuales el semen es procesado para mejorar la calidad que los criadores reciben. Sin embargo, a pesar de las distintas mejoras que se han hecho a la IA, la probabilidad de que un espermatozoide fertilice un óvulo depende de que al menos uno sobreviva en el sitio de fertilización hasta el arribo del óvulo. Este fenómeno depende de otros muchos factores [3], como el tiempo de supervivencia del espermatozoide en el tracto reproductivo femenino, la probabilidad de que el esperma inseminado alcance el sitio de fertilización, el número de espermatozoides inseminados en la fertilidad, factores ambientales, el método de almacenaje, temporada, edad del toro [4], la refrigeración y criopreservación del semen [5], etc.
La mala calidad del semen del ganado bovino, después de la descongelación, es una seria limitación en el éxito de la IA en la especie. Este fenómeno es provocado por una pérdida del 25 al 50% de mortalidad debido a la criopreservación [6,7].
Recientemente, se han evaluado procesos de tratamiento del semen, después de la congelación, con dos distintos métodos:
i) lavado dos veces con búfer de ácido cítrico mediante centrifugación y resuspendiéndolo en el mismo volumen original con el mismo búfer;
ii) o mediante el paso del semen a través de columnas de gel dextrano [6].
Se estudió la cantidad de espermatozoides sobrevivientes después de los procesos de tratamiento i) y ii). Los resultados concluyen que un simple procedimiento de lavado, seguido de un extensor adecuado es eficaz para el rendimiento del semen después de la congelación.
También, se han evaluado métodos de control de velocidades de enfriamiento del semen, donde el rango de temperaturas analizadas fue desde la temperatura ambiente hasta 4°C, a una velocidad de enfriamiento de 4.2°C/min para el enfriamiento de las muestras control y 0.1°C/min para el enfriamiento de las muestras tratadas [7]. Los resultados obtenidos indicaron que independientemente de la velocidad de enfriamiento del semen, el beneficio es el mismo, ya que se registraron los mismos parámetros de viabilidad al descongelarse y al usarse en la IA.
La yema de huevo, ha sido un método muy recurrente en la criopreservación del semen. Sin embargo, la yema de huevo y leche introducen un riesgo de contaminación microbiana, con la posterior producción de endotoxinas capaces de dañar la capacidad de fertilización de los espermatozoides [8]. Debido a esto se han buscado prolongadores, que ayuden a la conservación del semen, como la lecitina de soja mezclado con la yema de huevo con búfer (Figura 2). Los resultados de todos estos estudios muestran las comparaciones de los diferentes diluyentes usados para la criopreservación del semen del ganado vacuno, principalmente. En conclusión, los prolongadores conservan al semen, unos con mayor eficacia que otros, pero sin resaltar grandes diferencias.

Continuamente, en los últimos años ha habido discusiones frecuentes contra el uso de yema de huevo o leche, una de las cuales es la amplia variabilidad de la composición que hace que sea difícil analizar los efectos beneficiosos de un compuesto en particular en la criopreservación del semen [9].
Como se ha visto, a pesar de las múltiples ventajas que pueden presentar los diferentes métodos de criopreservación del esperma de ganado, también presentan muchas desventajas, las cuales no han permitido estandarizar un método eficaz y seguro en la criopreservación del esperma. El uso de la yema de huevo para la criopreservación del semen presenta algunos inconvenientes, como se ha mencionado arriba, sin embargo, los fosfolípidos, componente principal de la yema, pueden proteger por sí solos a los espermatozoides en el proceso de criopreservación [10,11].
Se han estudiado a los fosfolípidos, formando liposomas, como otras alternativas al uso de la yema de huevo, de manera que no dañen al semen y ayudándolo a conservarse a cualquier temperatura de almacenaje, como lo describen Röpke y col., quienes estudiaron el efecto de liposomas unilamelares, de varios fosfolípidos con diferente composición química en la criopreservación del semen de ganado bovino [11]. Los resultados muestran a los fosfolípidos más viables para la criopreservación del semen. La Figura 3 muestra los diagramas de fase, usando la posición de las bandas de vibración de tensión simétrica, derivada de las cadenas de los fosfolípidos, como una medida del desorden conformacional de la membrana.

Los autores también reportan el efecto de un extensor (búfer), complementado con diferentes concentraciones de liposomas de EPC (Fosfatidilcolina de huevo) para diferentes concentraciones y tiempos de congelación. Se evalúa la viabilidad del esperma, es decir, el plasma y la integridad de la membrana acrosomal, mediante citometría de flujo, concluyendo que el esperma sobrevive más tiempo, antes y después de la congelación, para concentraciones más altas de liposomas y tiempos de incubación.
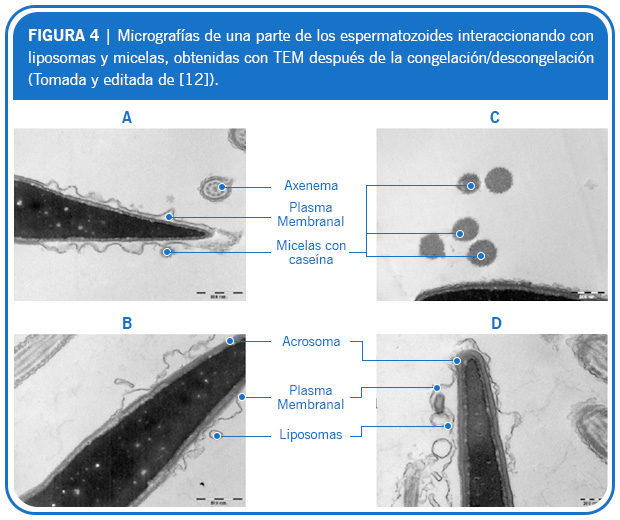
Pillet y col. utilizaron liposomas como una alternativa a la yema de huevo, haciendo una comparación entre ambos, en la congelación/descongelación de semen de caballo [12]. El objetivo del estudio fue probar las capacidades de criopreservación de los liposomas compuestos de fosfolípidos extraídos de la yema de huevo. Parte de los resultados del trabajo se muestran en la Figura 4, mostrando la interacción de un espermatozoide con los liposomas, mediante micrografías tomadas con el microscopio electrónico de transmisión (TEM). En la Figura se señalan las interacciones del espermatozoide con micelas con caseína (A y D) después de la congelación/descongelación; con liposomas de EPC80 (B y C) y con liposomas marcados con caseína. De todos los resultados obtenidos, los autores concluyen que los liposomas compuestos de EPC parecen ser una alternativa prometedora para remplazar a la yema de huevo en la criopreservación del semen de caballo.
JUSTIFICACIÓN
El estudio de la viabilidad y de los efectos de los liposomas para la criopreservación del esperma de ganado, en particular el del ganado bovino, han sido muy escasos, a pesar de que los resultados obtenidos muestran que pueden ser una alternativa al ya muy utilizado método del uso de la yema de huevo. Los estudios con los liposomas han mostrado que estos interaccionan muy bien con los espermatozoides cuando, por ejemplo, son incubados por grandes periodos a 4°C. Esto, debido a que probablemente estas interacciones facilitan la transferencia de lípidos a la membrana del espermatozoide causando una reorganización de sus componentes, las cuales afectan, de manera positiva, a la crioestabilidad del espermatozoide. Sin embargo, el estado de la fase que presentan los lípidos, que constituyen a los liposomas, aún no es un factor determinante que explica la acción de los lípidos como un crioprotector. También se ha visto que los liposomas compuestos de EPC muestran un comportamiento protector al momento de mezclarlos con semen y congelarlos, presentando una alternativa muy prometedora como remplazo a la yema de huevo. No obstante, todavía es necesario optimizar su composición para obtener mejores y concluyentes resultados, aprovechando la ventaja de que los liposomas no presentan toxicidad, ya que están formados por los mismos componentes con los que está hecha la membrana plasmática de los espermatozoides.
HIPÓTESIS
1. Es posible mejorar el método de criopreservación del semen de ganado mediante el uso de liposomas de diferente composición, conociendo mejor sus propiedades fisicoquímicas. La caracterización fisicoquímica incrementa el conocimiento de la formación, morfología, propiedades eléctricas y mecánicas de los liposomas, características importantes que ayudan a mejorar su interacción con semen bovino, la cual es muy importante e indispensable en el proceso de la IA. Generalmente, la fabricación de liposomas es planeada de acuerdo al uso que se les va a dar a los liposomas, es decir, eligiendo el material con el que se van a fabricar. En la fabricación de liposomas catiónicos es de suma importancia el porcentaje y el tipo de fosfolípidos neutros que se utilizan, pues estos mejoran su estabilidad, misma que se requiere para la criopreservación.
2. Es posible utilizar a los liposomas en el proceso final de la IA sin causar citotoxicidad. La carga superficial de los liposomas varía de acuerdo al porcentaje de fosfolípidos neutros, y esta carga se requiere para asegurar una buena complejación con el semen, pero de manera que no afecte su membrana plasmática y por ende que no sea tóxica al momento de la gestación. Los liposomas, cuya composición sea la más beneficiosa para la criopreservación del semen, serán también utilizados en proceso final en la IA.
RESULTADOS
Para la fabricación de liposomas se utilizaron fosfolípidos (lecitina) purificados de la yema de huevo, y ambos se caracterizaron física y químicamente mediante distintas técnicas experimentales. En la Figura 5 se presentan resultados experimentales de la investigación que aproximan la eficacia de los liposomas en la criopreservación de semen bovino. Los espectros de ultravioleta-visible (UV-Vis), infrarrojo por transformada de Fourier (FTIR) y Raman, Figura 5A, 5B y 5C respectivamente, muestran la puridad de la lecitina una vez extraída de la yema de huevo.

Los liposomas fabricados con los fosfolípidos de lecitina, presentan un valor del potencial Z (?) negativo (Fig. 5D), de acuerdo a la carga eléctrica de la lecitina y cuyo tamaño (diámetro, d) en un rango entre 0.5 y 3 ?m, con un índice de polidispersidad (PdI) alto (Fig. 5D). La micrografía de microscopia confocal (MC) muestra a los liposomas de lecitina marcados con un fosfolípido comercial fluorescente NBD-PE (Figura 5E), donde se observa claramente la forma, tamaño y contorno de los liposomas. De la misma forma, la micrografía de la Figura 5F muestra la interacción de los liposomas con los espermatozoides, señalados con flechas amarillas. Fácilmente se pueden cubrir a los espermatozoides con suficientes liposomas para la protección de la membrana celular.
CONCLUSIÓN
De acuerdo a los resultados preliminares, se puede concluir que los liposomas fabricados de lecitina de la yema de huevo interaccionan con el semen bovino, a quien protegerán en el proceso de criopreservación, aumentando su porcentaje de viabilidad y motilidad después de la descongelación y por ende al éxito de la fecundación en la IA.
PERSPECTIVAS
Con la ayuda de distintas técnicas experimentales, como lo son: la microscopia electrónica de transmisión (TEM), microscopia electrónica de barrido (SEM), citometría de flujo, etc., se podrá analizar y cuantificar de mejor manera la interacción de los liposomas con el semen, la viabilidad y motilidad en los procesos de congelación/descongelación a diferentes tiempos.
REFERENCIAS
[1] K. Rossiianov. Sci. Cont. 2002; 15(2): 277-316.
[2] J. Gadea. Spanish J. Agric. Res. 2003; 1(2): 17-27.
[3] P. Shannon. J. Reprod. Fert. 1978; 54: 519-527.
[4] L.F.C. Brito, et al. Anim. Reprod. Sci. 2002; 70: 181-190.
[5] A. Januskauskas et al. Theriogenology. 1999; 52: 641-658.
[6] R.L. Goyal, et al. Theriogenology. 1996; 46: 679-686.
[7] P. Sutovsky and C.E. Kennedy. Indust. Biotech. 2013; 9(1): 24-30.
[8] Viviana A. Aires, et al. Theriogenology. 2003; 60: 269-279.
[9] A.M. van Wagtendonk-de Leeuw, et al. Theriogenology. 2000; 54: 57-67.
[10] P. J. Quinn, et al. J. Reprod. Fert. 1980; 60: 403-407.
[11] T. Röpke, et al. Theriogenology. 2011; 76: 1465-1472.
[12] E. Pillet, et al. Theriogenology. 2012; 77: 268-279.